|
|
|
| NESTA EDIÇÃO |

 |
|
|
Robert
Horvitz |
|
 |
|
|
Sydney
Brenner |
|
 |
|
|
John
Sulston |
|
| Avanços
da ciência são responsáveis por grandes mudanças
na vida da humanidade. Homens e mulheres hoje têm maior expectativa
de vida, por exemplo, por causa do estudo e das descobertas científicas
daqueles que mergulharam neste mundo cheio de surpresas. O Prêmio
Nobel, dado anualmente desde 1901 para as áreas de física,
química, medicina e fisiologia, literatura, economia e para
quem promove a paz, tem como preocupação pré-estabelecida
por seu idealizador, o inventor da dinamite Alfred Nobel, homenagear
aqueles que contribuem para a melhoria da qualidade de vida e para
o avanço da sociedade, seja através da ciência,
da arte, da cultura ou da religião. Este
ano, o Prêmio Nobel de Medicina e Fisiologia foi dividido
entre três cientistas: os ingleses Sydney Brenner e John Sulston
e o norte-americano Robert Horvitz. Suas descobertas acerca da regulação
genética do desenvolvimento dos órgãos e tecidos
e sobre o processo de morte celular programada – também
conhecido como “suicídio”das células –
foram reconhecidas pela sua importância mundial, principalmente
no que se refere à saúde. O corpo
humano consiste em milhares de tipos de células, todas originárias
do óvulo fertilizado. Durante o processo embrionário
e o período fetal, o número de células cresce
demasiadamente. Mais tarde, elas amadurecem e especializam-se na
forma de vários tecidos e órgãos para a formação
do corpo. No entanto, muitas células também surgem
somente na fase adulta. Paralelamente
a essa geração de células novas, o processo
de morte que outras sofrem também é normal. “Durante
a formação de nossas mãos, por exemplo, várias
células tiveram que morrer para que nossos dedos pudessem
ser formados de maneira adequada. E assim acontece com outras partes
do nosso corpo, como na formação do nosso tubo digestivo,
por exemplo”, explica o professor do Departamento de Imunologia
do Instituto de Ciências Biomédicas (ICB) da USP, Gustavo
P. Amarante-Mendes. “Outro exemplo interessante é a
morte que acontece durante a regressão da cauda do girino
em seu processo de metamorfose até tornar-se o sapo adulto”,
exemplifica o professor. Genes
que matam Cada
um dos três vencedores teve participação bem
definida nas várias etapas do estudo. Sydney Brenner, por
exemplo, foi quem definiu que o verme Caenorhabditis elegans era
uma boa espécie para servir como modelo de organismo. Trata-se
de um animal multicelular, relativamente simples, microscópico
e transparente, que pode ser facilmente observado durante seu desenvolvimento.
De acordo com Amarante-Mendes, Brenner é contemporâneo
à descoberta da estrutura do DNA, e foi a partir disso que
decidiu dedicar-se à tentativa desenvolver um sistema biológico
onde se tentasse ver qual era a relação entre genes
e proteínas no desenvolvimento dos tecidos e dos órgãos
desde o embrião. Em 1974, Brenner demonstrou que mutações
em alguns genes específicos do Caenorhabditis elegans podiam
ser induzidas através do uso de um composto químico
chamado EMS (Ethyl Methane Sulphonate), e que diferentes mutações
poderiam estar relacionadas a genes específicos e a determinados
efeitos no desenvolvimento dos órgãos. Foi essa combinação
de análise genética com a visualização
das divisões celulares observadas que possibilitaram a ida
de parte do prêmio a Brenner. John
Sulston estendeu o trabalho de Brenner com o C. elegans e desenvolveu
técnicas para estudar todas as divisões celulares
no nemátodo. Brenner já havia descoberto que o animal
possuía 1.090 células somáticas, mas que, ao
longo de seu desenvolvimento, 131 morriam, sobrando 959 no final. Sulston
estudou todas as divisões, da época embrionária
à fase adulta. Em 1976, ele descreveu a linhagem celular
para uma parte do desenvolvimento do sistema nervoso. Com isso,
ele provou que a linhagem é invariável, ou seja, em
todos os vermes ocorreriam a divisão e a morte das mesmas
células, sempre no mesmo tempo programado. Sulston descreveu
os passos visíveis do processo de morte celular e demonstrou
a primeira mutação genética que faz parte dele. Coube
a Robert Horvitz continuar o trabalho dos colegas investigando,
também no C. elegans, onde havia um programa genético
controlador da morte celular. “Foi ele quem mapeou, definiu
e caracterizou os genes mais importantes que regulam a morte daquelas
131 células. Horvitz descobriu três genes que, trabalhando
em conjunto, induzem à morte”, conta Amarante-Mendes. Os
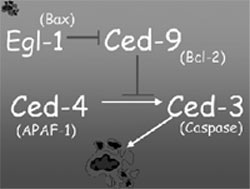
genes descobertos por Horvitz foram chamados EGL-1, CED-4, CED-3
e CED-9. Os três primeiros são os indutores à
morte. O gene CED-4 ativa o CED-3, que é conhecido também
como molécula efetora – aquela que efetiva a ação
– conduzindo, assim, à morte. O gene CED-9 é
o que impede que o CED-4 ative o CED-3, funcionando dessa forma
para aquelas células que não devem morrer. Quando
uma célula realmente tem que morrer, é o EGL-1 que
entra em ação para evitar que o CED-9 “seqüestre”
o CED-4. Importância
para a saúde humana Amarante-Mendes
exemplifica que, se no caso do verme, a molécula executora
é só o CED-3, no caso de mamíferos já
foram clonadas 14 moléculas que possuem a mesma formação
estrutural e funcional. Ele conta que há uma família
de proteases – enzimas que quebram proteínas –,
chamadas caspases, que podem ser subdivididas em dois grupos: o
que é relacionado a processos inflamatórios e um outro
relacionado à morte celular programada ou apoptose. As
caspases envolvidas no processo de apoptose em mamíferos
ainda são subdividas em dois subgrupos, chamadas de iniciadores
e executores do processo, o que ilustra a maior complexidade do
processo em animais superiores. O conhecimento da morte celular programada tem ajudado a compreender mecanismos utilizados por alguns vírus e bactérias para invadir células humanas. Também é sabido que no caso da Aids, de doenças neurodegenerativas e do infarte no miocárdio, por exemplo, células são perdidas como um resultado do número excessivo de mortes. Ao contrário, doenças como alguns tipos de câncer são caracterizadas por uma extrema redução no número de mortes celulares, deixando vivas as que deveriam morrer. Atualmente, a pesquisa sobre a morte programada celular é intensa, principalmente no campo da procura pela cura do câncer.
O professor
Gustavo Amarante-Mendes, que chefia o laboratório de biologia
celular e molecular e trabalha na área há mais de
dez anos, coordena no ICB da USP um estudo de mecanismos moleculares
que controlam o processo de morte celular programada em mamíferos,
principalmente em células humanas e de camundongos. O trabalho
concentra-se basicamente em duas áreas: resistência
à morte celular induzida pelo oncogene bcr-abl, que é
responsável pela patologia associada a determinadas formas
de leucemia; e a que diz respeito ao controle da morte celular em
linfócitos, que são as principais células de
defesa do corpo humano contra agentes infecciosos. Uma desregulação
da morte de linfócitos pode levar a doenças auto-imunes
ou imunodeficiências nas pessoas. No
primeiro caso, a resistência à morte pode levar a tipos
de leucemia como a mielóide crônica e as agudas linfocíticas.
|
O Jornal da USP é um órgão da Universidade de São Paulo, publicado pela Divisão de Mídias Impressas da Coordenadoria de Comunicação Social da USP.
[EXPEDIENTE] [EMAIL]